STEREOKIMIA LANJUT PERSENYAWAAN KIMIA ORGANIK
Stereokimia merupakan ilmu yang mempelajari molekul-molekul dalam suatu ruang 3 dimensi, yaitu bagaimana atom-atom dalam suatu molekul diatur dalam satu ruangan yang relatif terhadap yang lainnya. Pertemuan sebelumnya kita telah membahas konformasi struktur. Dimna konformasi struktur ini merupakan penataan gugus fungsi yang dapat memberikan manfaat tertentu pada gugus tersebut. Kita ketahui bahwa konformasi dan stereokimia ini saling berhubungan dengan itu kita dapat membedakannya dengan mengumpamakannya. Contoh pada suatu ruangan kelas dimana setiap harinya kita duduk di tempat yang berbeda-beda peristiwa seperti ini bisa disebut sebagai konformasi sedangkan posisi kita duduk dalam suatu ruangan kelas itu sama tetapi arahnya berbeda seperti kita menghadap kesamping peristiwa seperti ini bisa dikatakan sebagai stereokimia. Pada stereokimia ini terdapat 3 aspek diantaranya yaitu:
- Isomer geometrik : yang diakibatkan adanya ketegaran dalam molekul dan dapat membentuk isomer.
- Konformasi molekul : menyangkut bentuk molekul dan bagaimana suatu bentuk molekul ini dapat berubah.
- Kiralitas molekul : berkaitan dengan suatu penataan kanan atau kiri yang terletak di sekitar atom karbon yang dapat menimbulkan isomer.
1. ISOMER GEOMETRIK
Isomer merupakan sebuah molekul yang jenis dan jumlah atomnya sama namun susunan atomnya yang berbeda. Terdapat dua jenis isomer yaitu:Isomer struktural meru pakan senyawa dengan rumus molekul sama tetapi pada letak penataan atom yang berbeda dan pada isomer struktural hanya ada satu macam isomer. Pada macam kedua ialah isomer geometrik yang disebabkan oleh ketegaran yang terdapat dalam molekul dan hanya dapat dijumpai pada dua kelas senyawa: alkena dan senyawa siklik yaitu suatu stereoisomer yang berbeda dikarenakan gugus yang berada pada suatu sisi atau pada sisi-sisi yang berlawanan terhadap posisi ketegaran molekulnya.
Suatu molekul bukanlah suatu partikel statik yang hanya berdiam diri. Mereka juga bisa berputar, membengkokkan diri, dan bergerak. Sebuah atom dan gugus yang terikat hanya pada ikatan sigma bisa berputar sehingga bantuk dari keseluruhan molekul selalu berubah-ubah dan berkesinambungan. Namun pada gugus-gugus yang terikat pada suatu ikatan rangkap ia tidak bisa berputar dengan adanya ikatan rangkap itu yang berperan sebagai sumbu, dengan tidak memlepaskan ikatang phi itu. Suatu energi yang diperlukan untuk melepaskan ikatan phi pada karbon-karbon kira-kira sebesar (68 kkal/mol) yang tidak tersedia untuk molekul itu sendiri pada temperatur kamar. Sebab suatu ketegatan ikatan phi inilah gugus-gugus yang terikat pada karbon berikatan phi mempunyai posisi tetap dalam suatu ruang relatuf satu sama lainnya.
2. KIRALITAS
Kita misalkan tangan kiri kita, tangan kiri ini tidak bisa diimpitkan dengan bayangan yang ada dicermin. Jika tangan kiri kita diletakkan di depan cermi, maka bayangan cerminnya mirip dengan tangan kanan kita. Namun, bila tak punya cermin kita bisa mengkatupkan tangan kiri dan tangan kanan kita dengan tapak yang satu menghadap tapak yang lainnya. Maka akan terlihat sepasang bayangan cermin.
Suatu objek yang tidak bisa diimpitkan pada sebuah bayangan cerminnya bisa disebut kiral (chirar; Yunani; cheir, "tangan"). Sedangkan ojek yang bisa diimpitkan pada bayangan cerminnya disebut akiral (tak kiral). Asas-asas kekanankiri ini juga berlaku terhadap suatu molekul. Jika sebuah molekul yang tidak bisa diimpitkan pada sebuah bayangan cerminnya yang disebut sebagai kiral.
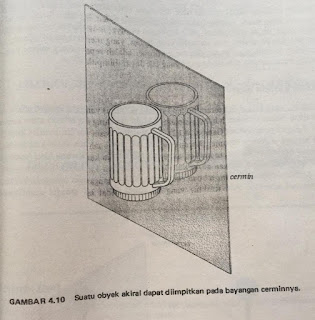
Contoh suatu objek kiral:
Contoh suatu objek akiral:
Untuk konformasi molekul kita telah membahasnya minggu lalu jadi saya tidak menjelaskan kembali materi tentang konformasi.
STEREOISOMER
Stereoisomer merupakan aspek dari stereokimia, dimana stereoisomer itu sendiri merupakan senyawa berlainan yang memiliki struktur sama, tetapi yang berbeda hanya dalam cara atomnya diatur dalam ruang tiga dimensi.
- Enantiomer dapat didefinisikan sebagai bayangan cermin yang muncul sepasang demi pasang dan tak bisa diimpitkan satu sama lain.
- Diastereoisomer merupakan pasangan stereoisomer yang bukan enantiomer, yang tak mempunyai bayangan cermin satu sama lainnya dan memiliki lebih dari satu pusat kiral.
- Senyawa Meso yaitu sebuah stereoisomer yang menyimpan karbon-karbon kiral, namun bisa diimpitkan dengan bayangan cerminnya dan mempunyai 1 fungsi tertentu.
PERMASALAHAN
- Jelaskan perbedaaan antara kiral dan akiral!
- Jelaskan perbedaan enantiomer dan senyawa meso serta berikan contohnya!
- Mengapa ketegaran isomer geometrik hanya dijumpai pada senyawa alkena dan siklik?


Hai Riska
BalasHapusperkenalkan saya Vinni Sridayanti Nim A1C117030, saya akan mencoba menjawab permasalahan no. 3
menurut saya hal yang menyebabkan ketegaran isomer geometrik hanya dijumpai pada senyawa alkena siklik yaitu dikarenakan gugus yang berada pada alkena siklik berada pada sisi-sisi yang berlawanan terhadap posisi ketegaran molekulnya.
Komentar ini telah dihapus oleh pengarang.
BalasHapusHai, saya Siti May Saroh dengan NIM A1C117048 akan mencoba menjawab permasalahan no 2. Enontiomer dapat didefinisikan sebagai bayangan cermin yang muncul sepasang demi pasang dan tak bisa diimpitkan satu sama lain. sedangkan senyawa meso yaitu sebuah stereoisomer yang menyimpan karbon-karbon kiral, namun bisa diimpitkan dengan bayangan cerminnya dan mempunyai 1 fungsi tertentu. contohnya yaitu 2,3 diklorobutana menghasilkan 2 enantiomer dan 1 senyawa meso. semoga membantu :)
BalasHapusPerkenalkan saya Angesti Dhitya dengan NIM A1C117004 akan menjawab permasalah pertama yaitu perbedaan antara kiral dan akiral . Kiral adalah suatu molekul yang tidak dapat menghimpit bayangan cermin dari molekulnya. Sedangkan akiral adalah molekul yang dapat menghimpit bayangan cermin dari molekulnya.
BalasHapus